【临床研究】浮游器筛选后精子超微结构变化和IVF-ET结局分析:一项随机对照试验
作者:
曹晓敏 刘丽 邸建永 刘烨 张美姿 徐凤琴
作者单位:
天津市第一中心医院生殖医学科 300192
通信作者:
徐凤琴,Email:xufengqin1968@126.com,电话:+86-13652169698
摘要
目的 寻找体外受精(in vitro fertilization,IVF)过程中合适的精液处理方法。
方法 本研究采用前瞻性随机对照双盲设计,选取300例因女性因素且男性生育力检查未见异常行IVF-胚胎移植(embryo transfer,ET)助孕的不孕夫妇为研究对象,纳入的患者通过计算机产生随机数进行随机化分组,分为浮游组(新型无损伤精子筛选技术,FY组,n=100)、密度梯度组(DG组,n=100)和上游组(SU 组,n=100)。收集三组患者受精后剩余的精子观察精子超微结构,并比较三组优选后精子DNA 碎片指数(DNA fragment index,DFI)及IVF-ET治疗过程中的受精率、卵裂率、优质胚胎率及妊娠率等指标之间的差异。
结果 FY组精子DFI显著低于DG组和SU组(3.22%±2.73%比8.31%±2.14%比6.43%±2.56%),差异有统计学意义(P=0.02),FY 组的精子头、尾部质膜完整率明显高于其他两组(92.0%±24.2%比80.2%±29.5% 比 73.2%±30.1%和93.9%±1.2%比80.1%±1.1%比74.9%±1.2%),差异具有统计学意义(P=0.01,P=0.03)。FY组的优质胚胎率、囊胚形成率明显高于DG组和SU组[44.14% (452/1024)比32.30%(292/904)比32.46%(296/912)和54.40%(396/728)比43.52%(302/694)比46.34% (330/712)],差异均具有统计学意义(P均<0.001)。新鲜周期FY组的妊娠率和植入率明显高于DG组和SU组[57.14%(24/42)比 33.33%(16/48)比35.56%(16/45)和 50.00%(30/60)比27.45%(14/51)比 28.26%(13/46)],差异具有统计学意义(P=0.04,P=0.02)。复苏周期FY组的妊娠率和植入率明显高于DG组和SU组[52.38%(22/42)比 31.25%(10/32)比 37.14%(13/35)和52.38%(22/42)比29.41%(10/34)比30.56%(11/36)],差异具有统计学意义(P=0.03,P=0.02)。
结论 浮游法可减少对精子造成的物理损伤,提高精子质膜的完整率,降低精子DFI,改善辅助生殖技术结局。
【关键词】密度梯度法;上游法;精子超微结构;受精,体外;胚胎移植;精子优选;浮游法
基金项目:天津市第一中心医院院内春风科研基金(院CF201810)
DOI:10.3760/cma.j.cn101441-20200508-00266
.png)
自1978年世界上第一例试管婴儿诞生后辅助生殖技术(assisted reproductive technology, ART)在全球快速普及,解决了许多不孕患者的生育问题,但临床数据报道ART治疗效率并不高。2018年美国、欧洲生殖与不孕协会报道每个移植胚胎的妊娠率和活产率分别为37%和25%[1-2]。这种低效率与多种因素有关,除了精子本身受精功能障碍或卵子异常外,精子体外处理方法的选择和效果也是重要的原因之一。因此从精液中筛选出活力、形态、受精潜能最优的精子是ART的关键环节之一。目前实验室常规使用的密度梯度法和上游法筛选精子过程包括离心和数次的洗涤操作,离心后精液中活性氧急剧增高,使得携带变性DNA的精子比例增加[3],含有DNA碎片的精子可能具有使卵子受精的能力,但对胚胎发育会造成影响,引起胚胎发育减慢、甚至早期死亡[4]。处理过程中多次离心也会对精子的细胞结构造成损伤,精子的质膜是最容易损伤的部位,精子单位膜完整性遭到破坏将会影响精子正常的新陈代谢、受精、卵裂和胚胎发育[5]。上游法对精液质量有所限制,只适用于优选精液质量好的标本,而且回收效率低。综上,目前胚胎实验室常规使用的精子制备技术尚不完善,处理过程无法避免对精子造成医源性的损伤。
精子浮游器是模拟女性体内对精子的自然筛选过程,浮游管内含造型类似宫颈的粉红色通液孔,使精子直接从液化精液中上游到培养液中,跨过浮游通孔的上缘进入凹槽内,不经历密度梯度、离心和洗涤等过程,富集最优的精子用于体外受精(in vitro fertilization, IVF),该方法理论上可替代密度梯度法和上游法处理精液标本,该方法是否适合少弱精子、附睾精子等标本的处理目前尚无数据发表。精子浮游器是海外资深的专业人士研发的一款用于精液优化的专利产品,并于2019年在中国成功获批辅助生殖耗材产品注册证,开始投入市场使用。我科室率先使用了该产品,目前尚无相关文献报道。
为深入了解浮游器与本中心主流使用的密度梯度法和上游法优化后精子的差别,本研究借助透射电子显微镜技术对精子头膜系统、顶体、轴丝、尾部质膜等进行观察,对比三种精液处理方法优化后精子细微结构和精子DNA碎片指数(DNA fragment index,DFI)等的差异,并比较三种方法处理后精子的受精和胚胎发育情况及胚胎移植后的临床结局信息。
资料与方法
一.
研究对象
选取2018年12月至2020年4月期间就诊于天津市第一中心医院生殖医学科的因女性因素及不明原因不孕的夫妇作为研究对象,包括盆腔及输卵管因素、排卵障碍、3次以上夫精宫腔内人工授精(intrauterine insemination,IUI)未孕、子宫内膜异位症、多囊卵巢综合征等。男方生育力未见异常,收集辅助生殖治疗周期受精后剩余的精子。样本量的计算公式为n=[PA(1-PA)+PB(1-PB)][Z1-α/(2τ)+Z1-βPA-PB]2,其中PA为精子浮游器法的研究对象妊娠率,估计值0.55,PB为密度梯度法/上游法的研究对象妊娠率,估计值0.4,α为一类错误的概率,值为0.05,β为二类错误的概率,值为0.25,Z为正态分布相应概率下的Z值,τ为组间比较的次数,值为2,本研究所需样本量为276,考虑到研究中可能存在研究对象的脱落,本研究最终样本量为300。本研究经天津市第一中心医院医学伦理委员会批准(2018N147KY),所有患者均签署知情同意书并自愿参加本研究。
二.
纳入、排除标准和分组
纳入标准:男方禁欲3~5 d后取卵日采集的精液,激素检查[卵泡刺激素(follicle-stimulating hormone, FSH)、黄体生成素(luteinizing hormone,LH)、泌乳素和睾酮]正常,精液量>1.5 mL,精子浓度>15×106/mL,总活力>40%,正常形态>4%,DFI<25%。排除标准:①女方获卵数小于5个;②附睾、睾丸取精患者;③少弱精子症患者;④泌尿系感染、精索静脉曲张患者;⑤男方遗传学检查异常的患者;⑥男方近3个月有危险化学品、放射性物质接触史,近3个月进行抗氧化、抗炎治疗。本研究是随机对照双盲试验,并进行了严格的分配隐藏,通过计算机产生随机数进行随机化分组。根据不同精子优化处理方法分为浮游组(FY组,采用浮游器法优选精子)、密度梯度组(DG组,采用密度梯度离心法优选精子)和上游组(SU组,采用上游法优选精子)。
三.
研究方法
1.密度梯度法优选精子:在锥形离心管底加入 2 mL 90%的sperm grad液(瑞典Vitrolife公司),其上加入2 mL 45%的sperm grad液,最后将2 mL的精液加在梯度的上面,离心760×g 15 min,沉淀物用G-IVF plus(瑞典Vitrolife公司)连续悬浮并离心2次,每次离心380×g 5 min,最后在沉淀中加入受精液,并调整精子浓度为5×106/mL用于受精。
2.上游法优选精子:在15 mL锥形离心管内加入2 mL G-IVF plus,将精液缓慢加入到培养液的下层,倾斜45°放置培养箱中孵育60 min。小心吸取上清液,于另一个15 mL锥形离心管中,380×g离心5 min,弃上清,保留底部沉淀。0.5 mL G-IVF plus液重悬精子沉淀团,调整精子浓度为5×106/mL用于受精。
3.精子浮游器优选精子:浮游器的制作材料聚丙烯(青岛瑞柏生物股份有限公司),由15 mL的圆底试管和内部的浮游通孔组成,浮游通孔直径6 mm,通孔外围是凹槽。取1 mL G-IVF plus加入浮游器的底部,将1 mL的精液缓慢加入到培养液下层,上层液面刚好超过粉红色的浮游通孔的上缘,使凹槽内充满液体,置于45°倾角的配套试管架内于5% CO2、36 ℃的培养箱中孵育30~60 min,精液中活力好的精子首先通过浮游通孔上游到凹槽中,轻轻吸取凹槽中的精子,调整精子浓度为5×106/mL用于受精(图1)。
.png)
4.精子DNA碎片检测:根据试剂盒的操作说明书(深圳博锐德生物科技有限公司),新鲜精液用PBS调制浓度5×106/mL,加入低熔点琼脂糖凝胶室温下混均,加20 μL精子凝胶混合液于处理载玻片上,4 ℃水平放置5 min。放入酸性DNA变形液中,室温孵育7 min。浸泡于裂解液中20 min。洗去残留液,依次放入70%、90%和99.9%乙醇中各2 min脱水。晒干后玻片用瑞氏染色液,流水冲洗、晒干。详细步骤参见文献[6]。在显微镜下对每个样品评估200个精子,小光晕或无光晕的精子被认为含有碎裂的DNA。
5.透射电子显微镜标本制备:上述三种方法处理前、后的精子与来自同一女性卵泡液的颗粒细胞块共同孵育,使精子吸附在颗粒细胞块上,将颗粒细胞块放于2.5%戊二醛溶液中固定4 ℃过夜,电子显微镜标本制作过程如文献所述[7]。标本在Leica EM UC 7型超薄切片机中切片,获得的切片经柠檬酸铅溶液和醋酸双氧铀50%乙醇饱和溶液染色后,在Hitachi H-7650型透射电子显微镜下观察,每个样品评估100个精子,重复观察3遍。
6.控制性促排卵和IVF:控制性促排卵按本科室操作常规进行[8],促排卵过程中,当有≥2个卵泡直径≥18 mm时,当晚肌内注射人绒毛膜促性腺激素(human chorionic gonadotropin,hCG,浙江仙琚制药厂)5000~10 000 IU,hCG注射36 h后行阴道超声引导下取卵术,hCG注射后40 h常规受精。受精后16~20 h观察到2个原核为正常受精。胚胎在6% CO2、5%O2和饱和湿度的培养箱中培养,在第3日(day 3, D3)的胚胎根据2011年美国、欧洲生殖与不孕协会提出的分级进行评分[9]。除因黄体期促排卵、高孕激素状态下促排卵方案、胚胎移植日孕酮水平高、输卵管积水、内膜不适合移植的患者行全部胎冷冻保存外,其余的患者进行新鲜胚胎移植。本中心卵裂期胚胎冷冻标准:D3卵裂球数7~9个,Ⅰ~Ⅱ级胚胎,剩余的胚胎行囊胚培养,囊胚的评分依据Gander分级法[10]。囊胚冷冻标准:选择D5或D6的3期以上,内细胞团或滋养层评分为B级以上的囊胚。优质囊胚的形态学评分标准是D5或D6的3期以上,内细胞团和滋养层评分为B级或A级的囊胚。
7.冻融胚胎移植(frozen-thawed embryo transfer,FET)方案:采用激素替代人工周期、自然周期和促排卵周期准备子宫内膜,当内膜厚度≥8 mm,口服地屈孕酮(达芙通,美国雅培)30 mg/d使子宫内膜转化为分泌期,内膜转化3~5 d进行解冻胚胎移植,移植后给予黄体支持。
8.妊娠判断:胚胎移植后14 d查尿hCG阳性、血hCG>30 IU/L者为生化妊娠;胚胎移植后28~30 d经阴道超声检查,宫腔内见孕囊者为临床妊娠。
观察指标
主要观察指标:DFI=核DNA碎裂精子数/精子总数×100%,精子头部膜完整率=精子膜不完整个数/精子总数×100%,临床妊娠率=临床妊娠周期数/移植周期数×100%;次要观察指标:种植率=B超下见孕囊数/移植胚胎数×100%。
统计学方法
采用SPSS20.0统计软件进行统计分析,本研究计量资料均符合正态性分布,数据以均数±标准差(±s)表示,采用方差分析进行差异比较,组间两两比较采用SNK-q检验;计数资料采用率(%)表示,三组间比较采用χ2检验;P<0.05表示差异具有统计学意义。
结果
男方精液处理前后精子参数
经筛选共有300对夫妇纳入研究,每组各100对,FY组、DG组、SU组男方年龄分别为(30.68±3.35)岁、(30.96±3.69)岁和(31.47±4.33)岁,差异无统计学意义(P>0.05)。精液处理前后三组男方精子浓度、活率、前向运动精子的比例、正常形态精子比例差异均无统计学意义(P>0.05),且各组内部处理前后差异均无统计学意义(P>0.05)。精液处理后三组精子DFI差异有统计学意义(P=0.02),FY组精子DFI显著低于DG组(P=0.03)和SU组(P=0.02),DG组与SU组之间精子DFI差异无统计学意义(P=0.06)。详见表1。
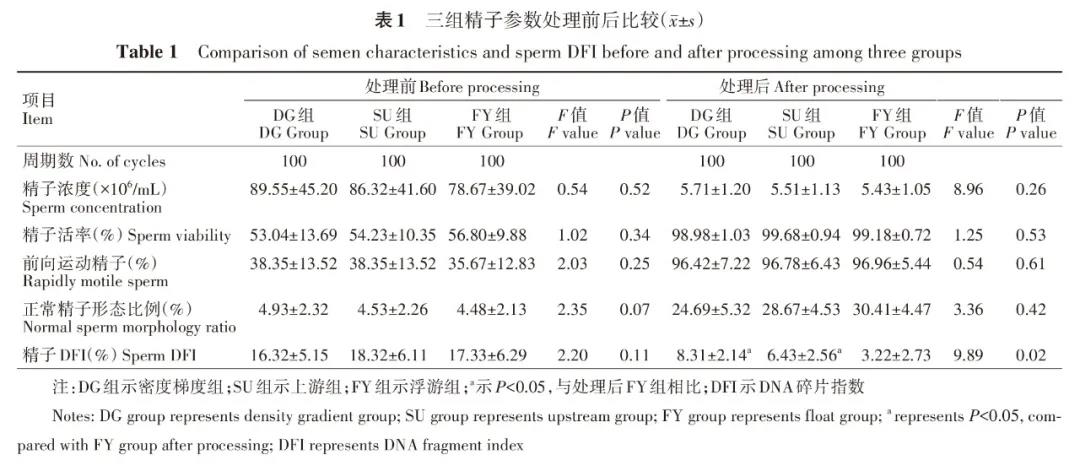
透射电子显微镜分析精子超微结构
正常的精子细胞膜完整并连续,顶体内容物均质,顶体内外膜清晰,核膜完整,细胞核密度较高,染色质均匀。精子头部异常包括精子膜肿胀、精子核空泡、质膜破裂、顶体内外膜肿胀/崩解,结构模糊,头部畸形。FY组精子头部正常比例较DG组、SU组高,差异有统计学意义(P=0.01),SU组精子头部异常比例低于DG组,但差异无统计学意义(P=0.15)。FY组精子尾部异常比例(包括线粒体、中心粒、微管的损伤)较其他两组明显降低,差异具有统计学意义(P=0.03),FY组精子尾部异常比例较SU组降低,但差异没有统计学意义(P=0.21),三组异常精子顶体反应比例差异无统计学意义(P=0.25),三组顶体损坏比例差异无统计学意义(P=0.41),详见图2、表2。
精子处理方法对IVF-ET结局的影响
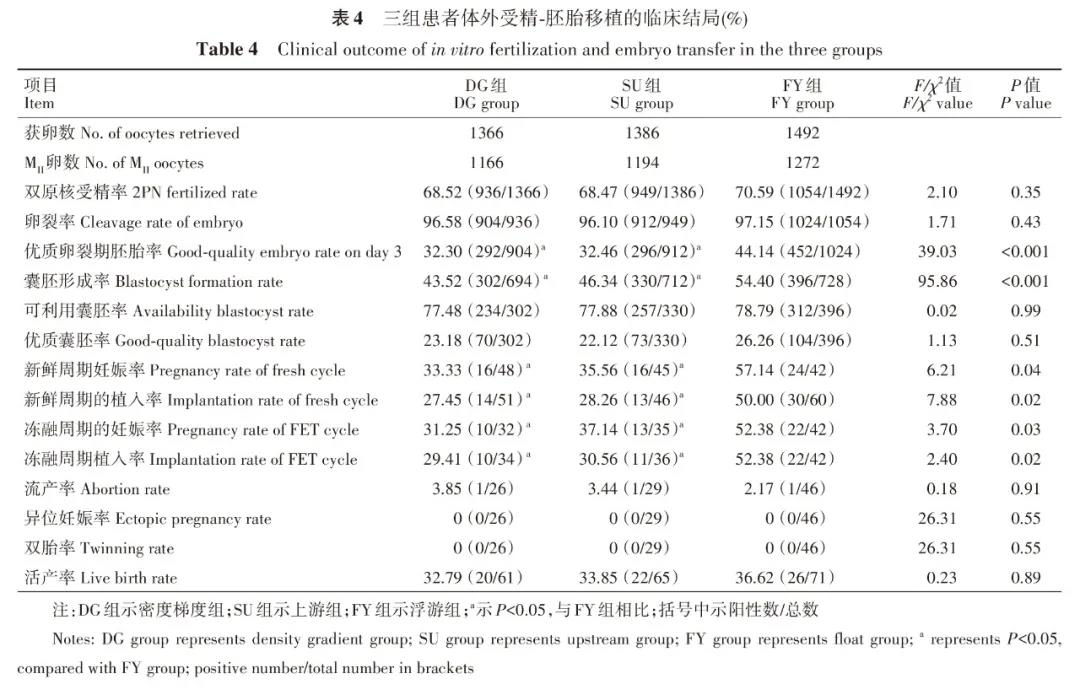
三组共纳入300个取卵周期,每组各100个,三组患者的年龄、体质量指数、血抗苗勒管激素(anti-Müllerian hormone,AMH)水平的差异均无统计学意义(P>0.05)(表3)。三组患者不孕类型构成比、控制性促排卵Gn用量和Gn使用时间差异均无统计学意义(P>0.05)。患者的受精率、卵裂率三组之间差异无统计学意义(P>0.05)。FY组的优质卵裂期胚胎率和囊胚形成率高于其他两组差异有统计学意义(P<0.05)。三组患者的平均移植胚胎数、平均移植优质胚胎数、子宫内膜厚度差异均无统计学意义(P>0.05)。新鲜周期FY组的妊娠率和植入率明显高于DG组、SU组(P<0.05),三组患者的内膜准备方案构成比、平均移植胚胎数、平均移植优质胚胎数、子宫内膜的厚度差异均无统计学意义(P>0.05)。复苏周期FY组的妊娠率和植入率明显高于其他两组,差异具有统计学意义(P<0.05),三组患者的流产率、异位妊娠率、双胎率及移植周期的分娩率差异均无统计学意义(P>0.05)(表3、表4)。
讨论
本研究第一次采用自然、无损伤的浮游器法优选精子,浮游法类似但不同于精子迁移沉淀技术,后者使用内含一锥形的特制玻璃或塑料管,使精子在1 h或更长的时间从液化精液上游到1 mL的上层培养液中,随后再沉淀到内部的锥形管的过程。而浮游法是使用商品化的浮游管和配套的试管架,浮游时倾斜45°,增加了精液与上层培养液的接触面,另外本方法浮游到上层的精子即进入到0.3 mL的凹槽内,无需沉淀过程,缩短上游的时间,减少精液液化后的精浆接触培养液可能引起的精子DNA损伤。浮游法也不同于上游法和密度梯度法,其优选精子过程不需要离心和数次洗涤,筛选精液中即能克服重力又能跨过浮游通孔的上缘进入凹槽的精子用于IVF。早期精液处理的目的是获得活力、形态良好的精子,但随着ART的发展,特别是引入卵母细胞质内单精子注射(intracytoplasmic sperm injection,ICSI)技术后,精子优选的重点转移到分离获取功能“健康”的精子用于受精,透射电子显微镜对精子形态的超微结构分析比光学显微镜更能准确地检测精子的异常,更精确地评估精子处理方法的安全性和有效性。精子质膜组成成分和完整性对其质量十分重要,功能完整的质膜是精子能够进行新陈代谢,完成获能和顶体反应,以及与透明带结合并穿过透明带的基础。精子的质膜也是最容易损伤的部位。本研究显示,FY组处理后精子头、尾部超微结构损伤比例较DG组和SU组明显降低(P<0.05)。文献报道精子质膜破裂、膜蛋白分子变性,不能与卵细胞相互吸引,会导致精卵识别障碍对受精过程产生负面影响[11]。但本文中三种方法优选的精子与卵子受精后三组之间受精率差异没有统计学意义。Wael等[12]报道顶体内能够溶解透明带的顶体素可能与顶体内膜有关,一定程度的精子质膜和顶体外膜的肿胀和破裂,只要顶体内膜和尾部中段未丢失,顶体素的活性就可能存在,精子仍具有使卵子受精的能力,但可能对胚胎发育造成影响。本研究中DG组和SU组处理后精子表现为精子质膜和顶体外膜的损伤,精子尾部中段的损伤为线粒体和中心粒细胞器的损伤,并未表现为中段的丢失,因此可能对受精的影响并不明显。本研究对象不孕的指征为单一女性因素所致,而男方生育力未见异常。文献报道离心对不育患者和生育力正常男性的精液影响结果不同,生育力正常男性的精液可耐受一定范围的离心力或只造成轻微的损伤[13]。因此,本研究的结果可能是样本选择的原因掩盖了三组患者精子超微结构的损伤程度及对受精的影响。Dutta等[14]报道,精子离心是机械性的剪切力,可引发精子膜一连串的反应,最终导致膜脂质过氧化,其中几乎60%的膜脂肪酸丢失,膜流动性降低,增强非特异性渗透离子,也抑制膜受体和酶的作用,甚至终止都会导致严重的精子功能障碍,蛋白质组学以及基因组水平的改变。研究也证明精子尾部细胞器的损伤可导致受精及早期胚胎发育的异常[15]。接下来我们将会观察离心对不同质量不同来源的精液膜和超微结构的影响。
精子染色体结构的完整性是评估精子质量的独立指标。精子染色质结构的完整性是成功受精和胚胎正常发育的必备条件。大量文献证实精子DNA损伤可能与ART治疗结局相关,与流产率和部分后代疾病发病率呈正相关[16-17]。本研究对比三组处理后精子DNA的完整性发现,FY组优化后精子DFI明显低于DG组和SU组(P<0.05),提示浮游法处理精液可降低处理过程对精子核DNA的损伤。目前常规使用的精液处理方法对精子超微结构的损伤已有大量的文献报道,Simon等[18]的研究显示密度梯度法处理精子的过程中会产生大量的活性氧会诱发氧化应激反应,导致精子DNA碎片率增加。Aitken等[19]使用不连续的硅胶体梯度制备精子时,发现处理后可精子DNA损伤增加。Muratori等[20]报道90例行ART治疗的夫妇使用密度梯度法处理精液,处理后检测精液中DNA碎片水平,其中41例患者处理后精液中DNA碎片水平较处理前升高(A组)。49例患者处理后精液中DNA水平较处理前降低(B组),胚胎移植后两组的妊娠率分别为17.1%和34.4%(P<0.05)。这项研究表明密度梯度法使大约一半受试者处理后DFI增加,并显示出更低的妊娠概率,总之目前的文献均提示应引起对这一精液处理程序的安全性的担忧。并认为在IVF/ICSI中DFI可作为妊娠结局的一个新的预后参数[21]。
既往的研究多通过精子的活力、形态、回收率等评估精液处理方法的有效性。很少关注其对受精及胚胎发育、囊胚形成及妊娠结局等方面的影响。本研究比较了三组患者的辅助生殖治疗情况,结果显示FY组D3优质胚胎率、囊胚形成率显著高于DG组和SU组(P<0.05),新鲜胚胎移植周期FY组的临床妊娠率与植入率明显高于DG组和SU组(P<0.05),解冻胚胎移植周期结果与新鲜周期一致。以上结果提示FY组的胚胎具有较好的发育潜能。推测可能归因FY组对精子损伤小,获得的精子质量高。文献报道胚胎基因组在第二次减速分裂后开始表达,精子质量对胚胎基因组的贡献非常重要,对囊胚发育的影响尤为明显[22]。我们的囊胚植入前遗传学检测结果也初步证明了这一观点,本研究三组患者囊胚通过比较遗传基因组杂交(comparative genomic hybridization,CGH)技术进行分析,发现FY组的囊胚整倍体率高于密度梯度组和上游组。由于病例少,本部分数据暂未发表。
综上,本研究结果表明,浮游器优选精子是模拟体内精子自然选择机制,不经历离心过程,富集精子所需时间短,可降低液化后精浆与培养液接触可能引起精子DNA损伤,该方法无创且费用低廉,操作过程简便只需一人一管,减少目前胚胎实验室精液处理过程中多次操作和双人核对环节,避免不同精液混淆的风险,在当前胚胎培养室工作人员超负荷工作的情况下,无疑是劳动力的巨大解放,而且最终提高了不孕患者辅助生殖治疗的效率,但鉴于目前数据量少,尚需扩大样本深入研究总结。
参考文献
向上滑动阅览
[1] CDC. 2016-Natonal Summary Report-Assisted Reproductive Technology[S]. Washington, DC: US Department of Health. Human Service, 2018.
[2] De Geyter C, Calhaz-Jorge C, Kupka MS, et al. ART in Europe, 2014: results generated from European registries by ESHRE: The European IVF-monitoring Consortium (EIM) for the European Society of Human Reproduction and Embryology (ESHRE)[J]. Hum Reprod, 2018, 33(9): 1586-1601. DOI: 10.1093/humrep/dey242.
[3] Muratori M, Tarozzi N, Carpentiero F, et al. Sperm selection with density gradient centrifugation and swim up: effect on DNA fragmentation in viable spermatozoa[J]. Sci Rep, 2019, 9(1): 7492. DOI: 10.1038/s41598-019-43981-2.
[4] Sharma RK, Said T, Agarwal A. Sperm DNA damage and its clinical relevance in assessing reproductive outcome[J]. Asian J Androl, 2004, 6(2): 139-148.
[5] Yamanaka M, Tomita K, Hashimoto S, et al. Combination of density gradient centrifugation and swim-up methods effectively decreases morphologically abnormal sperms[J]. J Reprod Dev, 2016, 62(6): 599-606. DOI: 10.1262/jrd.2016-112.
[6] Wang M, Sun J, Wang L, et al. Assessment of density gradient centrifugation (DGC) and sperm chromatin dispersion (SCD) measurements in couples with male factor infertility undergoing ICSI[J]. J Assist Reprod Genet, 2014, 31(12): 1655-1663. DOI: 10.1007/s10815-014-0339-4.
[7] Oliveira LZ, Hossepian de Lima VF, Levenhagen MA, et al. Transmission electron microscopy for characterization of acrosomal damage after Percoll gradient centrifugation of cryopreserved bovine spermatozoa[J]. J Vet Sci, 2011, 12(3): 267-272. DOI: 10.4142/jvs.2011.12.3.267.
[8] 刘丽, 曹晓敏, 张暄琳, 等. 选择性单胚胎移植策略探讨与临床结局分析[J].中华生殖与避孕杂志, 2020, 40(2): 101-109. DOI: 10.3760/cma.j.issn.2096-2916.2020.0026.
Liu L, Cao XM, Zhang XL, et al. Elective embryo transfer atrategy and clinical outcome analysis[J]. Chin J Reprod Contracep, 2020, 40(2):101-109. DOI: 10.3760/cma.j.issn.2096-2916.2020.0026.
[9] ALPHA Scientists In Reproductive Medicine; ESHRE Special Interest Group Embryology. Istanbul consensus workshop on embryo assessment: proceedings of an expert meeting[J]. Reprod Biomed Online, 2011, 22(6): 632-646. DOI: 10.1016/j.rbmo.2011. 02.001.
[10] Gardner DK, Lane M, Stevens J, et al. Blastocyst score affects implantation and pregnancy outcome: towards a single blastocyst transfer[J]. Fertil Steril, 2000, 73(6): 1155-1158. DOI: 10.1016/s0015-0282(00)00518-5.
[11] Tomes CN. Molecular mechanisms of membrane fusion during acrosomal exocytosis[J]. Soc Reprod Fertil Suppl, 2007, 65: 275-291.
[12] Khalil WA, El-Harairy MA, Zeidan A, et al. Evaluation of bull spermatozoa during and after cryopreservation: structural and ultrastructural insights[J]. Int J Vet Sci Med, 2018, 6 Suppl: S49-S56. DOI: 10.1016/j.ijvsm.2017.11.001.
[13] Zini A, Nam RK, Mak V, et al. Influence of initial semen quality on the integrity of human sperm DNA following semen processing[J]. Fertil Steril, 2000, 74(4): 824-827. DOI: 10.1016/s0015-0282(00)01495-3.
[14] Dutta S, Majzoub A, Agarwal A. Oxidative stress and sperm function: a systematic review on evaluation and management[J]. Arab J Urol, 2019, 17(2): 87-97. DOI: 10.1080/2090598X.2019.1599624.
[15] Lehti MS, Sironen A. Formation and function of sperm tail structures in association with sperm motility defects[J]. Biol Reprod, 2017, 97(4): 522-536. DOI: 10.1093/biolre/iox096.
[16] Coughlan C, Clarke H, Cutting R, et al. Sperm DNA fragmentation, recurrent implantation failure and recurrent miscarriage[J]. Asian J Androl, 2015, 17(4): 681-685. DOI: 10.4103/1008-682X.144946.
[17] Xue X, Wang WS, Shi JZ, et al. Efficacy of swim-up versus density gradient centrifugation in improving sperm deformity rate and DNA fragmentation index in semen samples from teratozoospermic patients[J]. J Assist Reprod Genet, 2014, 31(9): 1161-1166. DOI: 10.1007/s10815-014-0287-z.
[18] Simon L, Zini A, Dyachenko A, et al. A systematic review and meta-analysis to determine the effect of sperm DNA damage on in vitro fertilization and intracytoplasmic sperm injection outcome[J]. Asian J Androl, 2017, 19(1): 80-90. DOI: 10.4103/1008-682X.182822.
[19] Aitken RJ, Finnie JM, Muscio L, et al. Potential importance of transition metals in the induction of DNA damage by sperm preparation media[J]. Hum Reprod, 2014, 29(10): 2136-2147. DOI: 10.1093/humrep/deu204.
[20] Amiri I, Ghorbani M, Heshmati S. Comparison of the DNA fragmentation and the sperm parameters after processing by the density gradient and the swim up methods[J]. J Clin Diagn Res, 2012, 6(9): 1451-1453. DOI: 10.7860/JCDR/2012/4198.2530.
[21] Muratori M, Tarozzi N, Cambi M, et al. Variation of DNA fragmentation levels during density gradient sperm selection for assisted reproduction techniques: a possible new male predictive parameter of pregnancy?[J]. Medicine (Baltimore), 2016, 95(20): e3624. DOI: 10.1097/MD. 0000000000003624.
[22] Lee D, Jee BC. Evaluation of normal morphology, DNA fragmentation, and hyaluronic acid binding ability of human spermatozoa after using four different commercial media for density gradient centrifugation[J]. Clin Exp Reprod Med, 2019, 46(1): 8-13. DOI: 10.5653/cerm.2019.46.1.8.
本文来源:中华生殖与避孕杂志
经与曹晓敏博士沟通确认,文中使用的精子浮游器为我公司【瑞柏生物(中国)股份有限公司】自主研发专利产品——辅助生殖用精子浮游管。特此声明!

瑞柏生物(中国)股份有限公司
邮箱:info@reprobiotech.com 服务热线 : 400-002-0926 地址 : 山东省聊城市湖南路东首瑞柏中国

